سولفات آلومینیوم چیست؟
سولفات آلومینیوم یک ترکیب شیمیایی کریستالی با فرمول شیمیایی است که از واکنش و ترکیب عنصرهای آلومینیوم، اکسیژن و گوگرد به دست می آید. در حقیقت این ماده شیمیایی نوعی نمک محسوب می شود که به سه شکل گرانول خشک، مایع و مایع اسیدی در صنعت مورد استفاده قرار می گیرد. از جمله نام های دیگر آن، آلوم 17 درصد، کیک الوم، دی آلومینیوم تری سولفات، نمک آلومینیوم، زاج سفید سنت، آیو پاک هگزا دکا هیدرات و سولفات تصفیه آب است. سولفات آلومینیوم در صنایع مختلفی همچون آب و فاضلاب، غذا، کاغذسازی، کشاورزی، نساجی و رنگرزی، ساختمان سازی و ... کاربردهای بسیاری دارد. لازم به یادآوری است که در استفاده از این ماده شیمیایی باید نکات ایمنی لازم را رعایت کرد.

سولفات آلومینیوم؛ ویژگی ها و کاربردها
سولفات آلومینیوم (Alminium sulfate)یک ترکیب شیمیایی کریستالی با فرمول شیمیایی Al2(SO4)3 است که از واکنش و ترکیب عنصرهای آلومینیوم، اکسیژن و گوگرد به وجود می آید. این ماده شیمیایی نوعی نمک محسوب می شود که با خلوص 17درصد، به سه شکل گرانول خشک، مایع و مایع اسیدی در صنعت مورد استفاده قرار می گیرد. از جمله نام های دیگر آن می توان به آلوم 17 درصد، کیک الوم، دی آلومینیوم تری سولفات، نمک آلومینیوم، زاج سفید سنت، آیو پاک هگزا دکا هیدرات و سولفات تصفیه آب اشاره کرد.

ویژگی های سولفات آلومینیوم
از جمله ویژگی های این ماده شیمیایی می توان به موارد زیر اشاره کرد:
• سفید رنگ، بی بو و غی سمی است.
• دارای چگالی /2672 گرم بر سانتیمتر مکعب و جرم مولی 15/342 گرم بر مول است.
• غیرقابل اشتعال و غیرفرار است.
• به دو شکل مایع و پودر کریستالی وجود دارد و به رنگ های دیگری همچون گردویی و نباتی هم تولید می شود.
• محلول در آب و ناحلول در الکل ها (اتانول و متانول) و اسیدهای رقیق است.
• این ترکیب در دمای 770 درجه سانتیگراد ذوب و در دمای 330 درجه سانتیگرا به جوش می آید و دارای فشار بخار صفر است.
• اسیدی قوی است و زمانی که با آب ترکیب شود خاصیت اسیدی آن فعال می شود و PH آن کمتر از 2 می شود که همین ویزگی باعث خوردگی فلزات و سوختگی شیمیایی می شود.
• طعمی شیرین و تند و تیز دارد.
• دارای خاصیت حذف کننده ذرات رنگی و حذف کربن آلی است.
• یک منعقدکننده صنعتی و خنثی کننده شارژ الکتریکی است.
انواع سولفات آلومینیوم
این ماده شیمیایی از نظر رنگ و غلظت آهن به دو دسته A و B تقسیم می شود، نوع A از مواد جامد سفید رنگ و غلظت آهن کمتر از 5 0/0 درصد و نوع B آن از مواد جامد قهوه ای رنگ و غلظت آهن کمتر از ۱.۵
درصد ساخته می شود.
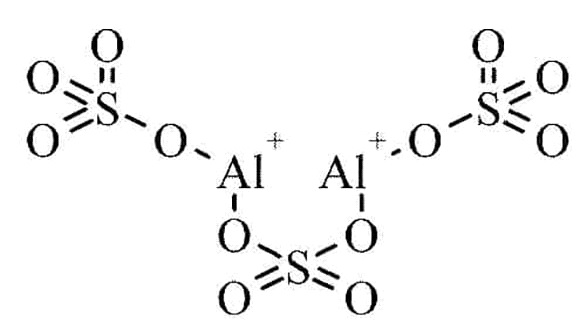
ساختار مولکولی سولفات آلومینیوم
تولید سولفات آلومینیوم
در میان ترکیبات آلومینیوم، سولفات آلومینیوم پس از اکسیدآلومینیوم پرکاربردترین ترکیب به شمار می رود که می توان آن را هم به صورت نمک ساده یا نمک مضاعف با سدیم، پتاسیم و آمونیوم تولید کرد که در این صورت «زاج آلومینیوم» نامیده می شود. مهمترین زاج این ترکیب نمک تشکیل شده با آمونیوم است که فرمول شیمیایی آن NH 4 AI(SO4)2 است.
آلومینیوم سولفات را به دو روش آزمایشگاهی می توان تهیه و تولید کرد:
- برای تولید این ماده در روش اول از واکنش اسیدسولفوریک با هیدروکسید آلومینیوم که یک ماده قلیایی است و نوعی دارو به شمار می رود، استفاده می کنند.
در این واکنش دو ماده یادشده را در دمای 225 تا 260 درجه فارنهایت و یک فشار معین در یک محفظه مخصوص عبور داده و ترکیب می کنند که بین 5 تا 45 دقیقه واکنش انجام می گیرد و پس از آن این مواد در یک میکسر مارپیچ مخلوط و سولفات آلومینیوم تولید می شود که فرمول شیمیایی آن در زیر آمده است:
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2
- همچنین اگر فلز آلومینیوم را در اسیدسولفوریک حرارت دهیم به گونه ای که در آن کاملا حل شود به این روش نیز می توانیم این ماده را تولید کنیم:
2Al (s) + 3H2SO4 → Al2(SO4)3 + 3H2 (g
- این ترکیب شیمیایی را معمولا به شکل هیدراته به کار می برند و رایج ترین شکل آن نمک 16 آبه و نمک 18 آبه است.

کاربردهای سولفات آلومینیوم در صنایع مختلف
این ماده شیمیایی در صنایع مختلف به شکل گسترده ای مورد استفاده قرار می گیرد که در ادامه به پاره ای از مهمترین آنها اشاره خواهیم کرد:
- صنعت آب و فاضلاب
یکی از مهمترین کاربردهای این ماده شیمیایی در صنعت تصفیه آب آشامیدنی و پساب های فاضلابی و صنعتی است که در این فرایند این ماده شیمیایی را به آب ناخالص اضافه می کنند، به علت خاصیت منعقدکنندگی زیادی که این ماده دارد رسوبات و ناخالصی های موجود در آب به هم می چسبند و به اصطلاح منعقد می شوند.
هر اندازه این ناخالصی ها بیشتر جمع و منعقد شوند به ذرات بزرگتری تبدیل شده که طی تصفیه آب بهتر شناسایی شده و به خوبی از فیلترها جدا می شوند. نکته قابل توجه در تصفیه آب این است که اگر از سولفات آلومینیوم به اندازه استاندارد استفاده نشود، این ماده نوعی آلودگی به شمار می رود و از این فرایند نتیجه ای حاصل نمی شود.
- صنعت نساجی و رنگرزی
یکی از روش هایی که در صنعت رنگرزی و نساجی برای تثبیت بیشتر رنگ و طرح روی الیاف و پارچه به کار می برند، استفاده از رسوب ژلاتینی است که این رسوب از حل شدن سولفات آلومینیوم در مقدار بسیاری آب به دست می آید، بدین ترتیب رسوب هیدرواکسید آلومینیوم که خاصیت ژلاتینی زیادی دارد، تولید می شود و همین امر به ثبات رنگ و دوام بالای چاپ روی پارچه منجر می شود.
- صنایع سلولوزی وکاغذسازی
این ماده شیمیایی با جذب آلودگی های یونی که معمولا در خمیر کاغذ وجود دارد، همچنین حفاظت از الیاف، رنگدانه ها و فیبرها در تولید کاغذ کاربرد دارد. در واقع به علت ویژگی منعقدکنندگی بالای سولفات آلومینیوم ذرات مختلفی که در خمیر کاغذ وجود دارد، به هم متصل می شود و در نتیجه باعث استحکام و براقیت کاغذ می شود.
- صنایع غذایی
در صنایع غذایی این ماده شیمیایی برای سفت کردن و بستن خمیر و شفاف کردن برخی از نوشیدنی ها کاربرد دارد. همچنین برای کنترل سطح PH در سبزیجاتی مانند گوجه فرنگی، چغندر و.... مورد استفاده قرار می گیرد. علاوه بر این در تولید شکر خام نیز کاربرد دارد.
سایر کاربردهای
این ماده معدنی یکی از پرمصرف ترین مواد در صنعت به شمار می رود، از این رو به پاره ای دیگر از کاربردهای آن می پردازیم.
- در کشاورزی برای کاهش دادن PH خاک زمین کشاورزی و تولید کود
- در صنعت داروسازی به عنوان مواد خام دارویی و برای تولید مسکن
- در صنایع ساختمان سازی، برای تولید فوم گچ، به عنوان بهبود دهنده و افزودنی برای ضد آب کردن بتن
- تولید فوم آتشنشانی برای اطفای حریق
- در صنایع آرایشی و بهداشتی در تهیه مواد ضدتعریق و دئودورانت ها
- در تهیه و تولید قطره های آلومینیومی استات و رزین های آلومینیومی
- برای تولید اتانول، گلیسیرین، چسب، مواد پاک کننده و نگهدارنده از وسایل چوب
- در صنعت چرم سازی
- صنایع صابون سازی
- تولید و تصفیه فلز روی

شرایط نگهداری
آلومینیوم سولفات را باید در ظروف فایبر گلاس، فولاد ضدزنگ و پلاستیک دوجداره نگهداری کرد. بهتر است که محیط آن خشک و خنک، دارای تهویه مناسب و بدون قرار گرفتن در معرض فشار باشد. اگر این ترکیب در معرض فشار قرار بگیرد، حالت کریستالی خود را از دست می دهد و شیرابه ای از آن خارج می شود و این ترکیب حالت کلوخه ای پیدا می کند.
تجزیه سولفات آلومینیوم
در صورتی که این ماده شیمیایی را در دمای 580 تا 900 درجه سانتیگراد حرارت بدهند، به گاز سمی تری اکسید سولفور و گاما آلومینا تجزیه می شود.
تولید سولفات آلومینیوم
این ماده شیمیایی به صورت ساده یا نمک مضاعف با پتاسیم، آمونیوم یا سدیم تولید می شود. به طور کلی دو واکنش اصلی برای تولید این ماده وجود دارد:
- واکنش میان اسیدسولفوریک و محلول آبدار حاوی هیدروکسید آلومینیوم (حلول آلومینا)
- گرم کردن آلومینیوم فلزی در محلول سولفوریک اسید
واکنش اول، باید در شرایط خاصی انجام شود. این واکنش باید در محفظه مخصوص، به صورت پیوسته، تحت فشار معین و در دمای 225 تا 260 درجه فانهایت انجام پذیرد. با عبور این دو ماده از محفظه واکنش به مدت 5 تا 45 دقیقه، 78 تا100 درصد از واکنش تکمیل می شود. پس از این مرحله، واکنش دهنده ها در یک میکسر با مسیر مارپیچ تغییر جهت دهنده قرار گرفته و با هم مخلوط می شوند، در نتیجه ترکیب شدن این مواد با هم، سولفات آلومینیوم به دست می آید.
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
واکنش دوم، شامل حرارت دادن فلز آلومینیوم در محلول اسیدسولفوریک است:
2Al (s) + 3H2SO4 → Al2(SO4)3 + 3H2 (g)
تجزیه و واکنش های شیمیایی
قرارگیری این ماده در معرض حرارت 580 تا 900 درجه سانتی گراد(تقریبا نقطه ذوب)، آن را به آلومینا و گوگرد تری اکسید (گاز سمی) تجزیه می کند. همچنین فرآورده های به دست آمده از این واکنش در ترکیب با آب، به نمک هیدراته تبدیل می شوند.
سولفات آلومینیوم در واکنش با آب
سولفات آلومینیوم در ترکیب با آب، عملکرد متفاوتی از خود نشان می دهد. در چنین شرایطی این ماده یون های مورد نیاز برای خنثی شدن ذرات کلوئیدی موجود در آب را تامین می کند. به این ترتیب ذرات به یکدیگر پیوسته و فایند لخته سازی یا کواگولاسیون انجام می شود. ین ماده بلافاصله پس از انحلال با عوامل قلیایی و کلوئیدهای موجود در آب وارد واکنش می شود. طی این واکنش، رسوب ژلاتینی هیدروکسید آلومینیوم تولید شده و کلوئیدها، ذرات و ناخالصی های معلق در آب را جذب می کند. به این ترتیب این ماده شیمیایی در آب به عنوان یک لخته ساز یا منعقدکننده عملکرد خوبی از خود نشان می دهد.
واکنش سولفات آلومینیوم با بی کربنات سدیم
از واکنش این ماده شیمیایی با بی کربنات سدیم نیز نوعی فوم به دست می آید که کربن دی اکسید مورد نیاز برای کپسول های آتش نشانی را تامین می کند.
Al2(SO4)3 + 6NaHCO3 → 3Na2SO4 + 2Al(OH)3 + 6CO2
کربن دی اکسید به دست آمده از این واکنش، توسط تثبیت کننده فوم به دام افتاده و لایه ای ضخیم روی سوخت های هیدروکربنی ایجاد می کند؛ این لایه مانع از دسترسی سوخت به اکسیژن شده و فرایند احتراق و آتش سوزی را متوقف می کند.
لازم به یادآوری است که این فوم شیمیایی تنها در مواردی خاص کاربرد داشته و انتخاب مناسبی برای استفاده در حلال های قطبی از قبیل الکل محسوب نمی شود.
نکات ایمنی در زمان استفاده سولفات آلومینیوم
این ترکیب شیمیایی بسیار اسیدی است و اگر بدون رعایت نکات ایمنی با آن کار کرد، آسیب های جدی برای انسان به دنبال خواهد داشت. بنابراین در صورت به کار بردن این ماده باید محیطی مجهز و ایمن فراهم کرد.
- هنگام استفاده از این ماده شیمیایی باید از عینک، دستکش و لباس ایمنی مناسب استفاده کرد.
- در صورت استنشاق ، گازی که این از ترکیب شیمیایی متصاعد می شود، سمی و خطرناک است پس باید بلافاصله شخص را به فضای آزاد برده و به سرعت به مراکز درمانی منتقل کرد.
- از تماس این ماده با پوست و چشم باید جلوگیری کرد؛ در غیر این صورت احتمال قرمزی، خارش یا احساس سوزش وجود دارد. در صورت تماس، باید چشم ها را به مدت 30 دقیقه با مقدار فراوان آب شسته و در اسرع وقت به پزشک مراجعه کرد. اگر داخل چشم ها لنز وجود دارد، باید پیش از شستشو آن را از چشم خود خارج کرد. همچنین در صورت تماس با پوست، لباس آلوده را به سرعت از تن خارج کرده و ناحیه تماس را با مقدار زیادی آب شست.
- استنشاق این ماده موجب سرفه کردن، برانگیختگی بینی، گلو و شش ها، تنگی نفس یا خس خس گلو می شود. در صورت استنشاق، فرد را باید از ناحیه تماس دور کرده و به فضای آزاد برد تا هوای تازه تنفس کند و در اسرع وقت نیز باید به پزشک مراجعه کند
- این ماده با آب، رطوبت، آمونیاک، آمین ها و بازهای قوی نظیر سدیم هیدروکسید و پتاسیم هیدروکسید به شدت واکنش می دهد، از این رو باید همواره دور از مواد یاد شده نگهداری شود.
- پس از استفاده، ضایعات آن را با مواد خنثی کننده مخلوط کرده تا خورده شوند.
























